Basınç formülü kimyada nasıl kullanılır?
Bu makalede, kimyada basınç formülünün kullanımı ve gazların davranışını etkileyen temel yasalar ele alınmaktadır. Basınç, gazların özelliklerini anlamak ve kimyasal reaksiyonların dinamiklerini çözümlemek için kritik bir rol oynar. Boyle, Charles ve Avogadro yasaları ile bu ilişkiler detaylandırılmaktadır.
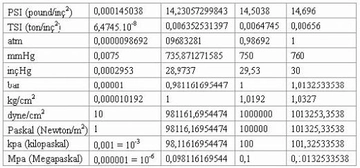
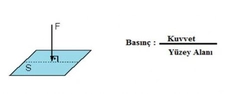
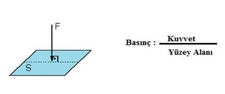
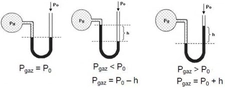
Basınç Formülü Kimyada Nasıl Kullanılır?Kimya, maddelerin özelliklerini, yapılarını ve etkileşimlerini inceleyen bir bilim dalıdır. Bu bağlamda, basınç formülü kimyasal reaksiyonlar ve gazların davranışları üzerinde önemli bir etkiye sahiptir. Bu makalede, basınç formülünün kimyasal hesaplamalarda nasıl kullanıldığını ele alacağız. Basınç Nedir?Basınç, birim alana düşen kuvvet olarak tanımlanır. Matematiksel olarak, basınç (P) aşağıdaki formülle ifade edilir:
Burada;- P: Basınç (Pascal cinsinden)- F: Uygulanan kuvvet (Newton cinsinden)- A: Alan (metrekare cinsinden) Gazların Davranışları ve BasınçGazların davranışları, basınç, sıcaklık ve hacim gibi parametrelerle doğrudan ilişkilidir. Gazların özelliklerini açıklamak için kullanılan temel yasalar şunlardır:
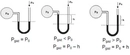
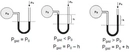
Bu yasalar, gazların basıncı ile hacim, sıcaklık ve molekül sayısı arasındaki ilişkileri anlamamıza yardımcı olur. Boyle YasasıBoyle Yasası, sabit sıcaklıkta bir gazın hacmi ile basıncı arasındaki ters orantıyı ifade eder. Matematiksel olarak, bu yasa şu şekilde ifade edilir:
Burada;- P1 ve P2: İlk ve son basınç- V1 ve V2: İlk ve son hacim Charles YasasıCharles Yasası, sabit basınçta bir gazın hacmi ile sıcaklığı arasındaki doğru orantıyı belirtir. Bu yasa şu şekilde ifade edilir:
Burada;- V1 ve V2: İlk ve son hacim- T1 ve T2: İlk ve son sıcaklık (Kelvin cinsinden) Avogadro YasasıAvogadro Yasası, sabit sıcaklık ve basınçta eşit hacimlerdeki gazların, eşit sayıda molekül içerdiğini belirtir. Bu yasa şu şekilde ifade edilir:
Burada;- V: Hacim- n: Molekül sayısı (mol cinsinden)- k: Sabit Basınç Formülünün Kimyasal Reaksiyonlardaki ÖnemiBasınç formülü, kimyasal reaksiyonların gerçekleşme koşullarını belirlemede kritik bir rol oynar. Özellikle gaz fazındaki reaksiyonlar için, basınç değişiklikleri, ürün oluşumunu ve reaksiyon hızını etkileyebilir. Reaksiyonların denklemlerinin doğru bir şekilde yazılması için basınç hesaplamaları yapılır. SonuçKimyada basınç formülünün kullanımı, gazların davranışlarını anlamak ve kimyasal reaksiyonların dinamiklerini çözümlemek için vazgeçilmezdir. Boyle, Charles ve Avogadro yasaları, basınç ve gazların özellikleri arasındaki ilişkileri açıklamada önemli bir temel sunar. Bu bilgilerin doğru bir şekilde uygulanması, kimyasal deneylerin ve hesaplamaların doğruluğunu artırır. Ek Bilgiler |