Gazların kısmi basıncı nedir ve nasıl hesaplanır?
Gazların kısmi basıncı, bir gaz karışımındaki her bir bileşen gazın toplam basınç içindeki katkısını ifade eder. Dalton'un Kısmi Basınçlar Yasası, her gazın kısmi basıncının mol oranıyla orantılı olduğunu belirtir. Bu kavram, gazların davranışını anlamak için önemlidir.
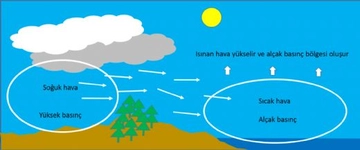
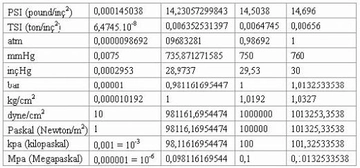
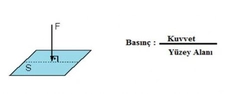
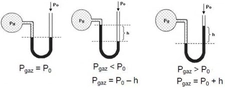
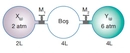
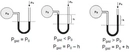
Gazların Kısmi Basıncı Nedir?Gazların kısmi basıncı, bir gaz karışımındaki bir bileşen gazının, toplam basınç altında oluşturduğu basınçtır. Her gaz, karışımda bulunan diğer gazların varlığından bağımsız olarak belirli bir basınç oluşturur. Kısmi basınç, Dalton'un Kısmi Basınçlar Yasası'na dayanarak, gazların karışımında her bir gazın basıncının toplam basınca katkısını ifade eder. Dalton'un Kısmi Basınçlar Yasası Dalton'un Kısmi Basınçlar Yasası, bir gaz karışımındaki her gazın kısmi basıncının, o gazın karışımdaki mol oranı ile orantılı olduğunu belirtir. Yani, bir gaz karışımındaki toplam basınç, karışımdaki her bir gazın kısmi basınçlarının toplamına eşittir. Matematiksel olarak ifade etmek gerekirse: P_total = P_1 + P_2 + P_3 +... + P_nBurada, P_total toplam basıncı, P_1, P_2, P_3... ise karışımdaki her bir gazın kısmi basıncını temsil eder. Kısmi Basıncın Hesaplanması Kısmi basıncın hesaplanması, karışımda bulunan gazların mol sayıları ile doğrudan ilişkilidir. Bir gazın kısmi basıncı, ideal gaz yasası kullanılarak hesaplanabilir. İdeal gaz yasası şu şekilde ifade edilir: PV = nRTBurada, P gazın basıncı, V hacmi, n mol sayısını, R gaz sabitini ve T sıcaklığı temsil eder. Kısmi basıncı hesaplamak için, belirli bir gazın mol sayısını ve karışımın toplam mol sayısını kullanarak kısmi basınç şöyle hesaplanabilir: P_i = (n_i / n_total) P_totalBurada, P_i gazın kısmi basıncı, n_i gazın mol sayısı, n_total toplam mol sayısı ve P_total toplam basıncı temsil eder. Örnek Hesaplama Bir karışımda 3 mol azot (N2) ve 2 mol oksijen (O2) bulunduğunu varsayalım. Toplam mole sayısı: n_total = n_N2 + n_O2 = 3 + 2 = 5 molEğer karışımın toplam basıncı 1 atm ise, her gazın kısmi basıncı: P_N2 = (n_N2 / n_total) P_total = (3 / 5) 1 atm = 0.6 atmP_O2 = (n_O2 / n_total) P_total = (2 / 5) 1 atm = 0.4 atm Uygulama Alanları Kısmi basınç hesaplamaları, gaz karışımlarının analizi ve kontrolü açısından son derece önemlidir. Özellikle, kimya mühendisliği, atmosfer bilimi ve biyomedikal mühendisliği gibi birçok alanda kısmi basınçların hesaplanması kritik bir rol oynamaktadır.
Sonuç Gazların kısmi basıncı, gaz karışımlarının davranışını anlamak ve analiz etmek için önemli bir kavramdır. Dalton'un Kısmi Basınçlar Yasası ve ideal gaz yasası kullanılarak hesaplanması, birçok bilim dalında uygulama alanı bulmaktadır. Kısmi basıncın doğru bir şekilde hesaplanması, gazların fiziksel ve kimyasal özelliklerinin anlaşılmasına yardımcı olur. |