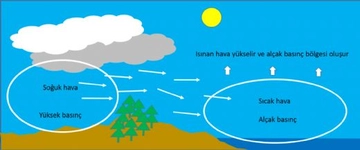
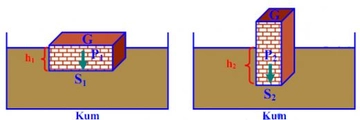
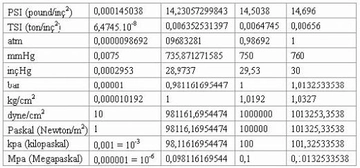
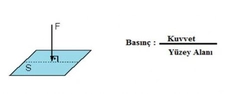
Mol sayısı ve basınç ilişkisi nedir?
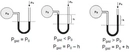
Mol sayısı ve basınç arasındaki ilişki, gazların davranışını anlamada kritik bir rol oynamaktadır. Özellikle ideal gaz yasası çerçevesinde, mol sayısının artması basıncı artırırken, gerçek gazlarda sapmaların dikkate alınması gerektiği vurgulanmaktadır. Bu ilişki, birçok pratik uygulamada önemli sonuçlar doğurmaktadır.
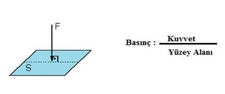
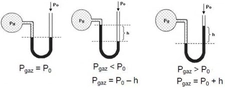
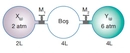
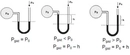
Mol Sayısı ve Basınç İlişkisi Nedir?Mol sayısı ve basınç arasındaki ilişki, gazların davranışını anlamada temel bir öneme sahiptir. Bu ilişki, özellikle ideal gaz yasası çerçevesinde incelenmektedir. 1. İdeal Gaz Yasası İdeal gaz yasası, bir gazın mol sayısı (n), basıncı (P), hacmi (V) ve sıcaklığı (T) arasındaki ilişkiyi tanımlayan temel bir denklem olarak karşımıza çıkar. Bu denklemi aşağıdaki gibi ifade edebiliriz:\[ PV = nRT \]Burada:- P: Gazın basıncı (atm, Pa vb.)- V: Gazın hacmi (L, m³ vb.)- n: Gazın mol sayısı- R: Gaz sabiti (0.0821 L·atm/(K·mol) veya 8.314 J/(K·mol))- T: Gazın sıcaklığı (Kelvin cinsinden) Bu denklem, bir gazın davranışını anlamak için temel bir araçtır. Mol sayısının artması, gazın hacmini artırmadan basıncın artmasına neden olur. 2. Basınç ve Mol Sayısı Arasındaki İlişki Basınç ve mol sayısı arasındaki ilişki, ideal gaz yasası çerçevesinde incelenebilir. Gazın hacmi ve sıcaklığı sabit tutulduğunda, mol sayısının artması, basıncın da artmasına sebep olur. Bu durum, aşağıdaki şekilde ifade edilebilir:- Hacim (V) ve sıcaklık (T) sabit olduğunda, basınç (P) ile mol sayısı (n) arasındaki ilişki:\[ P \propto n \]Bu denklem, daha fazla molekülün, daha fazla çarpışma ve dolayısıyla daha yüksek basınç anlamına geldiğini göstermektedir. 3. Uygulamalar ve Örnekler Bu ilişki, birçok pratik uygulamada önemli bir rol oynamaktadır. Örneğin:
4. Gerçek Gazlar ve Deviations Gerçek gazlar, ideal gaz yasasından sapmalar gösterebilir. Basınç ve mol sayısı arasındaki ilişki, gazın doğasına bağlı olarak değişebilir. Özellikle yüksek basınç ve düşük sıcaklık koşullarında, gaz molekülleri arasındaki etkileşimler göz önüne alınmalıdır. Van der Waals denklemi gibi düzeltici denklemler, bu sapmaları hesaba katmak için kullanılabilir. Sonuç Mol sayısı ve basınç arasındaki ilişki, gazların davranışını anlamada kritik bir öneme sahiptir. İdeal gaz yasası, bu ilişkiyi açıklarken, gerçek hayatta karşılaşılan durumlar için düzeltici önlemler alınması gerektiğini göstermektedir. Gazların davranışını etkileyen faktörlerin anlaşılması, birçok bilimsel ve endüstriyel uygulamada başarıya ulaşmak için gereklidir. |