
Basınç ve sıcaklık ilişkisi nedir, hangi formüller kullanılır?
Basınç ve sıcaklık arasındaki ilişki, gazların davranışını anlamak için kritik öneme sahiptir. İdeal gaz yasası gibi temel kavramlar, bu iki parametre arasındaki etkileşimi açıklayarak mühendislik ve bilim alanlarında uygulama imkanı sunar.
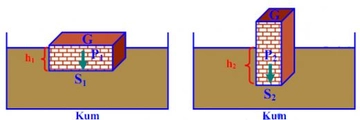
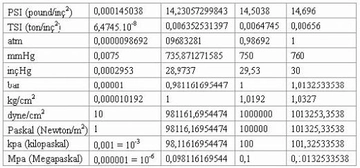
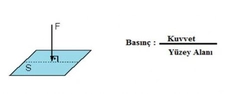
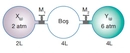
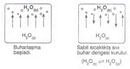
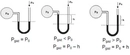
Basınç ve Sıcaklık İlişkisi Nedir?Basınç ve sıcaklık, fiziksel bilimlerin temel kavramları arasında yer almakta olup, birçok doğal ve endüstriyel süreçte kritik rol oynamaktadır. Bu iki parametre arasındaki ilişki, özellikle gazların davranışlarını anlamada hayati önem taşır. Basınç, bir yüzeye uygulanan kuvvetin birim alanına oranı olarak tanımlanırken, sıcaklık ise bir nesnenin veya sistemin termal enerjisinin bir ölçüsüdür. Gazların davranışlarını düzenleyen temel yasalar, bu iki değişkenin etkileşimini açıklamaktadır. Özellikle, ideal gaz yasası bu ilişkileri net bir şekilde ortaya koymaktadır. İdeal Gaz Yasasıİdeal gaz yasası, bir gazın basıncı (P), hacmi (V), sıcaklığı (T) ve mol sayısını (n) ilişkilendiren bir ifadedir. Bu yasa şu şekilde ifade edilir:\[ PV = nRT \]Burada;- \( P \): Basınç (Pa),- \( V \): Hacim (m³),- \( n \): Molar miktar (mol),- \( R \): Gaz sabiti (8.314 J/(mol·K)),- \( T \): Sıcaklık (K) dir. Bu denklem, ideal gazların davranışını tanımlamakta ve basınç ile sıcaklık arasındaki ilişkiyi anlamamıza yardımcı olmaktadır. Örneğin, sabit hacimde bir gazın sıcaklığını artırmak, basıncını da artıracaktır. Charles YasasıCharles yasası, bir gazın hacminin sıcaklık ile doğru orantılı olduğunu belirtir. Bu yasa şu şekilde ifade edilir:\[ \frac{V_1}{T_1} = \frac{V_2}{T_2} \]Burada;- \( V_1 \) ve \( V_2 \): İlk ve son hacim,- \( T_1 \) ve \( T_2 \): İlk ve son sıcaklık (Kelvin cinsinden) dir. Bu yasa, sıcaklık arttıkça bir gazın hacminin de arttığını göstermekte ve sabit bir basınç altında geçerlidir. Boyle YasasıBoyle yasası, bir gazın hacminin basınç ile ters orantılı olduğunu ifade eder. Yani, bir gazın basıncı arttıkça hacmi azalır. Bu yasa şu şekilde ifade edilir:\[ P_1 V_1 = P_2 V_2 \]Burada;- \( P_1 \) ve \( P_2 \): İlk ve son basınç,- \( V_1 \) ve \( V_2 \): İlk ve son hacimdir. Bu yasa, sabit sıcaklık koşullarında geçerlidir. Gay-Lussac YasasıGay-Lussac yasası, bir gazın basıncının sıcaklık ile doğru orantılı olduğunu belirtir. Bu yasa şu şekilde ifade edilir:\[ \frac{P_1}{T_1} = \frac{P_2}{T_2} \]Burada;- \( P_1 \) ve \( P_2 \): İlk ve son basınç,- \( T_1 \) ve \( T_2 \): İlk ve son sıcaklık (Kelvin cinsinden) dir. Bu ilişki, sabit bir hacimde gazın sıcaklığının arttıkça basıncının da artacağını gösterir. SonuçBasınç ve sıcaklık arasındaki ilişki, gazların fiziksel özelliklerini anlamak için temel bir öneme sahiptir. İdeal gaz yasası, Charles yasası, Boyle yasası ve Gay-Lussac yasası, bu ilişkiyi açıklayan temel formüllerdir. Bu yasaların anlaşılması, mühendislik, meteoroloji, kimya ve fizik gibi birçok alanda önemli bir yere sahiptir. Bu bilgiler ışığında, basınç ve sıcaklık arasındaki ilişkiyi daha derinlemesine anlamak için deneyler yapmak ve gerçek dünyadaki uygulamalarını incelemek faydalı olacaktır. Bu yasalar, gazların davranışlarını tahmin etmek ve çeşitli mühendislik uygulamalarında kullanmak için kritik öneme sahiptir. |

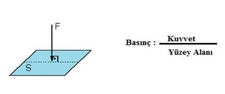
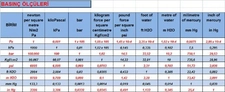
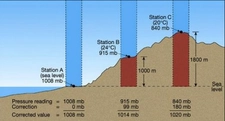
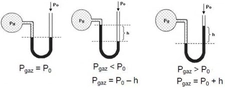



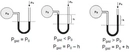











Bu yazıda basınç ve sıcaklık arasındaki ilişkiyi anlamak için önemli yasalar açıklanmış. Gerçekten de gazların davranışlarını anlamak için bu yasaları bilmek çok faydalı. Özellikle ideal gaz yasası, gazların basınç, hacim ve sıcaklık arasındaki dengeyi net bir şekilde ortaya koyuyor. Mesela, sabit hacimde bir gazın sıcaklığını artırdığınızda basıncının da artacağını bilmek, birçok endüstriyel uygulamada kritik bir öneme sahip. Charles yasası ile hacim ve sıcaklık arasındaki doğru orantı, Boyle yasası ile basınç ve hacim arasındaki ters orantı gibi bilgiler, gazların nasıl davrandığını anlamamıza yardımcı oluyor. Gay-Lussac yasası da, sabit hacimde gazın sıcaklığının artması ile basıncının nasıl değiştiğini açıklıyor. Bu bilgileri deneysel olarak test etmek, gerçek dünya uygulamalarıyla birleştirmek ve mühendislikte kullanmak, bu kavramların daha iyi anlaşılmasını sağlayacaktır. Sizce bu yasaların günlük yaşamda karşılaştığımız durumlarla nasıl bir bağlantısı var?
Değerli Tanyeli Hanım,
Gaz yasalarının günlük yaşamdaki bağlantıları gerçekten ilgi çekici. İşte bazı örnekler:
Yiyecek Paketleme
Cips paketlerinin içindeki gaz basıncı, ambalajın şişkin görünmesini sağlar. Sıcaklık değişimleri bu basıncı etkiler, bu nedenle paketler sıcak ortamlarda daha şişkin görünebilir.
Mutfak Uygulamaları
Düdüklü tencereler Gay-Lussac yasasını mükemmel şekilde gösterir. Kapalı hacimde su buharının sıcaklığı arttıkça basınç yükselir ve yemekler daha hızlı pişer.
Otomotiv Sistemleri
Araba lastiklerindeki hava basıncı mevsimlere göre değişir. Yazın sıcak havada lastik basıncı artar, kışın ise azalır - bu doğrudan sıcaklık-basınç ilişkisini yansıtır.
Meteorolojik Olaylar
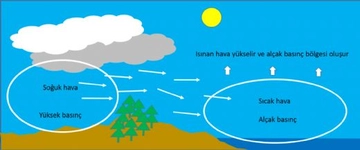
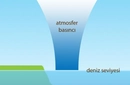
Hava basıncındaki değişimler hava durumunu belirler. Yüksek basınç alanları genellikle güneşli, düşük basınç alanları ise yağışlı hava getirir.
Spor Malzemeleri
Futbol ve basketbol toplarının iç basıncı ortam sıcaklığından etkilenir, bu da topun sıçrama özelliklerini değiştirebilir.
Bu örnekler, gaz yasalarının aslında günlük hayatımızın her köşesinde karşımıza çıktığını gösteriyor. Temel fizik kurallarını anlamak, etrafımızdaki olayları daha iyi yorumlamamıza yardımcı oluyor.