
Ideal gazda basınç ve sıcaklık nasıl ilişkilidir?
Ideal gazların basınç ve sıcaklık ilişkisi, fiziksel bilimlerde temel bir konudur. Bu ilişki, gazların davranışını anlamak için kritik öneme sahiptir. Sıcaklık arttıkça gaz moleküllerinin kinetik enerjisi yükselir, bu da basıncın artmasına neden olur. Gazların davranışını açıklayan ideal gaz yasası, bu ilişkiyi matematiksel olarak özetler.
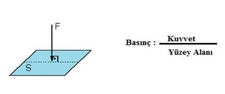
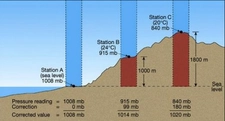
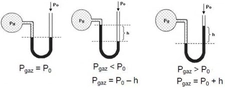
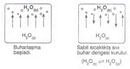
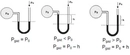
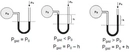
Ideal Gazda Basınç ve Sıcaklık İlişkisiIdeal gazlar, fiziksel bilimlerin temel konularından biridir ve gazların davranışlarını anlamak için önemli bir model sunar. Ideal gazlar, belirli koşullar altında davranışlarının basit ve öngörülebilir olduğunu varsayar. Bu makalede, ideal gazların basınç ve sıcaklık arasındaki ilişki incelenecektir. 1. Ideal Gaz YasasıIdeal gazların davranışını tanımlayan temel denklem, ideal gaz yasasıdır. Bu yasa, bir gazın basıncını (P), hacmini (V) ve sıcaklığını (T) birbirine bağlar. Ideal gaz yasası şu şekilde ifade edilir:\[ PV = nRT \]Burada;- P: Gazın basıncı (Pa)- V: Gazın hacmi (m³)- n: Gazın mol sayısı- R: Gaz sabiti (8.314 J/(mol·K))- T: Gazın sıcaklığı (K) Bu denklem, gazın sıcaklığındaki bir değişikliğin, basıncını nasıl etkilediğini göstermektedir. 2. Basınç ve Sıcaklık Arasındaki İlişkiIdeal gazın sıcaklığı ile basıncı arasındaki ilişki, doğrudan orantılıdır. Sıcaklık arttıkça, gaz moleküllerinin kinetik enerjisi artar; bu da moleküllerin daha hızlı hareket etmesine ve daha fazla çarpışmaya neden olur. Sonuç olarak, gazın basıncı da artar. Bu ilişki, sabit hacimdeki bir gaz için aşağıdaki gibi ifade edilebilir:\[ P \propto T \]Bu, belirli bir hacimdeki bir gazın sıcaklığı arttığında, basıncının da artacağı anlamına gelir. 3. Gazın Hacmi ve Basınç İlişkisiIdeal gaz yasasına göre, gazın hacmi sabit tutulduğunda, sıcaklıktaki bir artış, basıncın artmasına yol açar. Bunun tersi de geçerlidir; basınç sabit tutulduğunda, sıcaklık arttıkça gazın hacmi de artacaktır. Bu durum, gazın genişleyebilme yeteneğiyle ilişkilidir. 4. Gerçek Gazların DavranışıGerçek gazlar, ideal gaz yasasına tam olarak uymazlar. Sıcaklık ve basınç ekstrem değerlerde olduğunda, gazların moleküler etkileşimleri ve hacimlerinin etkisi göz ardı edilemez hale gelir. Bu nedenle, gerçek gazlar için Van der Waals denklemi gibi daha karmaşık ilişkiler kullanılır. 5. Uygulama AlanlarıBasınç ve sıcaklık arasındaki ilişki, birçok bilimsel ve endüstriyel uygulamada kritik öneme sahiptir. Örneğin:
Bu uygulamalar, gazların davranışlarını anlamak için ideal gaz yasasının nasıl kullanılabileceğine dair somut örnekler sunmaktadır. SonuçSonuç olarak, ideal gazlar için basınç ve sıcaklık arasındaki ilişki, fiziksel bilimlerin temel ilkelerinden biridir. Bu ilişki, gazların davranışını anlamak ve çeşitli uygulamalarda etkili çözümler geliştirmek için kritik bir öneme sahiptir. Ideal gaz yasası, bu ilişkiyi matematiksel bir formülle özetleyerek, gazların temel özelliklerini açıklamakta önemli bir rol oynamaktadır. Ekstra Bilgiler |
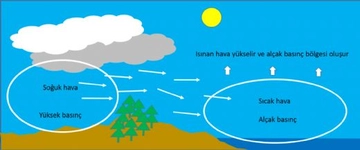
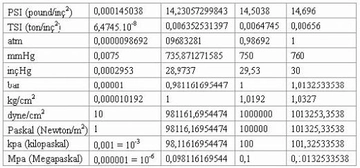
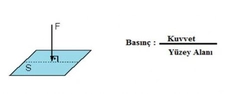















Ideal gazlar ile basınç ve sıcaklık arasındaki ilişkiyi açıklamak için ideal gaz yasası gerçekten çok önemli bir temel oluşturuyor. Yani, gazların sıcaklığı arttıkça basıncının da artacağını biliyoruz. Peki, bu durum pratikte nasıl bir etki yaratıyor? Örneğin, kapalı bir alan içinde sıcaklık yükseldiğinde, gazın basıncının artması, o alanın güvenliğini nasıl etkileyebilir? Ayrıca, gerçek gazların davranışının ideal gaz yasasından ne kadar farklılık gösterdiğini düşününce, bu durumun endüstriyel uygulamalarda yaratabileceği sorunlar neler olabilir?
Merhaba Badem Bey,
Pratik Etkiler ve Güvenlik: Kapalı bir alanda sıcaklık arttıkça, ideal gaz yasasına göre (PV=nRT) basınç da artar. Bu durum, örneğin basınçlı kaplar, tüpler, otoklavlar veya hatta basit bir sprey kutusunda bile kritik önem taşır. Aşırı sıcaklık artışları, tasarım basıncının aşılmasına ve patlama riskine yol açabilir. Bu nedenle endüstriyel sistemlerde basınç emniyet valfleri, sıcaklık sensörleri ve soğutma mekanizmaları kullanılır. Ayrıca, yangın durumunda kapalı alanlardaki basınç artışı, yapısal hasar ve yayılımı hızlandırabilir.
Gerçek Gazların Sapması ve Endüstriyel Sorunlar: İdeal gaz yasası, gaz moleküllerinin hacmini ve aralarındaki etkileşimleri ihmal eder. Gerçek gazlar, özellikle yüksek basınç ve düşük sıcaklıklarda bu varsayımlardan sapar. Endüstriyel uygulamalarda (doğal gaz sıkıştırma, petrokimya, soğutma sistemleri gibi) bu sapmalar şu sorunlara yol açabilir:
-
Hesaplama Hataları:
Proses tasarımında basınç, hacim veya sıcaklık tahminlerinin yanlış olması, verim kaybı veya ekipman arızalarına neden olabilir.
-
Güvenlik Riski:
Özellikle kritik basınç ve sıcaklık koşullarında, gerçek gaz davranışını dikkate almayan modeller, beklenmeyen basınç birikimleri yaratabilir.
-
Malzeme Seçimi:
Gerçek gazların sıkıştırılabilirlik faktörü (Z) dikkate alınmazsa, boru hatları veya tanklar yetersiz kalabilir, bu da sızıntı veya patlama riskini artırır.
-
Enerji Verimliliği:
Kompresör ve soğutucu sistemlerin performansı, gerçek gaz özelliklerine bağlıdır. İdeal yasaya dayalı hesaplamalar, enerji tüketiminde sapmalara yol açabilir.
Bu nedenle, endüstride Van der Waals veya diğer durum denklemleri gibi daha gelişmiş modeller kullanılarak gerçek gaz davranışı daha doğru şekilde tahmin edilir ve güvenlik önlemleri buna göre alınır.