
Kısmi Basınç Formülü Nelerdir?
Kısmi basınç, bir gazın veya sıvının belirli bir alandaki toplam basıncının, o alandaki diğer gazlar veya sıvıların basıncından bağımsız olarak ölçülen değeridir. Bu kavram, gazların davranışını anlamak ve mühendislik uygulamaları için kritik öneme sahiptir.
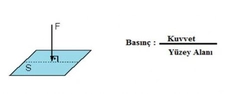
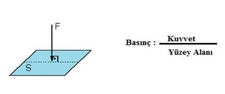
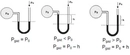
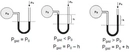
Kısmî Basınç Formülü Nedir?Kısmî basınç, bir gazın veya sıvının belirli bir alan üzerindeki toplam basıncının, o alanda bulunan diğer gazların veya sıvıların basıncından bağımsız olarak ölçülen basıncını ifade eder. Bu kavram, özellikle gazların davranışını anlamak ve çeşitli mühendislik uygulamalarında önemli bir yer tutmaktadır. Kısmî basınç formülü, belirli bir gazın, toplam basınç içindeki payını hesaplamak için kullanılmaktadır. Kısmî Basınç Formülünün Matematiksel İfadesi Kısmî basınç, genellikle aşağıdaki formül ile hesaplanır: Pᵢ = P_total - P_j
Bu formül, belirli bir gazın basıncını, toplam basınçtan diğer bileşenlerin basıncını çıkartarak bulmamızı sağlar. Kısmî Basınç ve Dalton'un Kısmi Basınçlar Yasası Kısmî basınç kavramı, Dalton'un Kısmi Basınçlar Yasası ile doğrudan ilişkilidir. Dalton'a göre, bir gaz karışımındaki her bir gaz, karışımın toplam basıncına kendi kısmi basıncı kadar katkıda bulunur. Bu yasa, gazların birbirleriyle etkileşime girmeden bağımsız olarak davranışlarını analiz etmemizi sağlar.
Kısmî Basınç Uygulamaları Kısmî basınç, birçok bilimsel ve mühendislik alanında kritik bir öneme sahiptir. Aşağıda bu alandaki bazı uygulamalar sıralanmıştır:
Kısmî Basınç Hesaplarının Önemi Kısmî basınç hesaplamaları, sistemlerdeki gazların davranışlarını anlamak için kritik bir yöntemdir. Bu hesaplamalar sayesinde, mühendisler ve bilim insanları sistemlerin verimliliğini artırabilir ve istenmeyen durumların önüne geçebilirler. Özellikle kimyasal tepkimelerin optimizasyonunda, kısmi basınçların doğru şekilde hesaplanması büyük önem taşır. Sonuç Kısmî basınç, gazların ve sıvıların davranışlarının anlaşılmasında önemli bir kavramdır. Dalton'un Kısmi Basınçlar Yasası ile birlikte, bu kavramın çeşitli uygulamaları, mühendislik ve bilim alanlarında geniş bir yelpazeye yayılmaktadır. Kısmî basınç formülü, gazların karışımları üzerinde etki eden faktörleri analiz etmek için kritik bir araçtır ve birçok endüstriyel uygulamada kullanılmaktadır. Bu makalede, kısmî basınç formülü ve bununla ilgili temel kavramlar, matematiksel ifadeler ve uygulama alanları ele alınmıştır. Kısmî basıncın daha iyi anlaşılması, bu alanda yapılacak çalışmalara yön verecektir. |
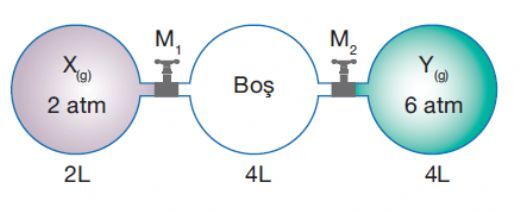
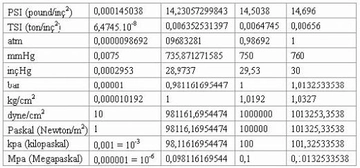



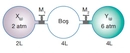
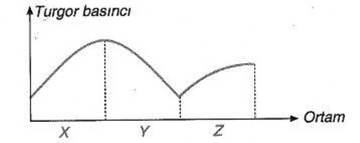












Dalton Yasası'nın geçerli olabilmesi için gazların ideal davranış sergilemesi gerektiğini söylüyorsunuz. Ancak gerçek hayatta bu koşulları tam olarak sağlamak gerçekten mümkün mü? Gerçek gazların davranışında hangi sapmalar gözlemlenir ve bu sapmaları hesaba katmak için hangi yöntemler kullanılır?
Bağışcan Bey,
Dalton Yasası'nın tam olarak geçerli olabilmesi için gazların ideal davranış sergilemesi gerektiği doğrudur. Ancak, gerçek hayatta gazlar ideal davranıştan sapmalar gösterebilirler. Gerçek gazlar, düşük sıcaklık ve yüksek basınç gibi koşullarda ideal gaz yasasından daha fazla sapma gösterirler. Bu sapmaların başlıca nedenleri şunlardır:
1. Moleküller Arası Çekim Kuvvetleri: Gerçek gaz molekülleri arasında Van der Waals kuvvetleri gibi çekim kuvvetleri bulunur, bu da gazların davranışını etkiler.
2. Moleküllerin Hacmi: İdeal gaz varsayımında gaz moleküllerinin hacmi ihmal edilir. Ancak, gerçek gazlarda moleküllerin belirli bir hacmi vardır ve bu hacim basınç ve sıcaklık koşulları altında gazın davranışını etkiler.
Bu sapmaları hesaba katmak için birkaç yöntem kullanılır:
1. Van der Waals Denklemi: Bu denklem, gazların davranışını daha doğru bir şekilde tahmin etmek için gaz molekülleri arasındaki çekim kuvvetlerini ve moleküllerin hacmini dikkate alır.
2. Virial Denklemi: Bu denklem, gazların ideal gaz davranışından sapmalarını daha doğrusal bir biçimde ifade eder ve genellikle deneysel veriler kullanılarak türetilir.
3. Peng-Robinson ve SRK (Soave-Redlich-Kwong) Denklemleri: Bu denklemler, özellikle mühendislik uygulamalarında sıkça kullanılır ve gazların termodinamik özelliklerini daha doğru bir şekilde tahmin eder.
Bu yöntemler, gerçek gazların davranışını daha doğru bir şekilde modellemek için kullanılır ve endüstriyel uygulamalarda önemli bir rol oynar.